Nova técnica de alteração de DNA permitiu que britânica de 13 anos alcançasse remissão de câncer considerado incurável Um novo…
Anvisa aceitará registro comercial de terapias que envolvem alteração DNA
Técnicas deste tipo eram regulamentadas antes apenas para uso experimental
A Anvisa (Agência Nacional de Vigilância Sanitária) aprovou na terça-feira (18) as regras para registro comercial no Brasil de terapias de saúde com modificação de DNA ou células cultivadas em laboratório.
Técnicas deste tipo eram regulamentadas antes apenas para uso experimental. O texto normativo aprovado pela diretoria colegiada da Anvisa classifica esses tratamentos como “terapias avançadas”. A agência diz que se enquadram na categoria qualquer técnica do gênero usada para “tratar, prevenir ou diagnosticar” doenças que não tenham cura ou tratamento por vias convencionais.
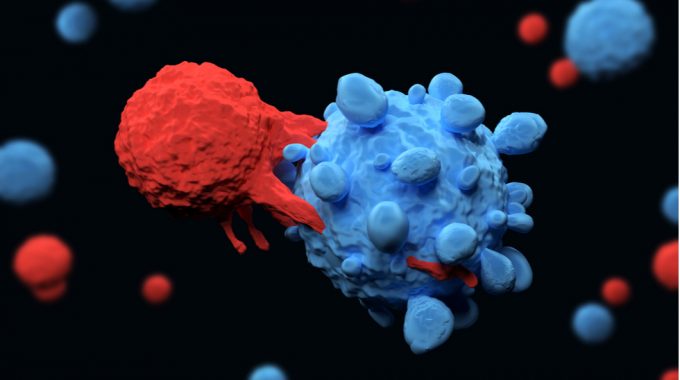
A área terapêutica inclui, por exemplo, o uso de células imunes geneticamente modificadas para combater o câncer, como foi feito com paciente recentemente em caráter experimental no Hospital de Clínicas de Ribeirão Preto. Outro tipo de terapia enquadrado na nova normativa é o uso de vírus com DNA alterado para tentar modificar o material genético de pacientes com doenças hereditárias.
“Essa é uma nova categoria de produto que tem prometido revolucionar a saúde no Brasil e no mundo”, afirma em vídeo Renata Parca, especialista da Anvisa que participou da criação as novas regras. “Essa regulamentação trata dos critérios mínimos de qualidade, segurança e eficácia que têm de ser provados para que a Anvisa registre e aprove a comercialização desses produtos no país”.
Testes clínicos
A Anvisa vem se debruçando sobre o tema desde 2018, quando aprovou duas resoluções para disciplinar os testes clínicos feitos com terapias avançadas. Qualquer pesquisa do tipo envolvendo humanos precisa ter o aval da agência. Até agora, a agência já recebeu no Brasil 13 pedidos de testes clínicos para terapias avançadas.
Entre estes, oito já foram aprovados, dois foram indeferidos e três estão em análise. Um dos tipos de terapia que a agência avalia agora é o uso de terapia gênica para distrofia de células da retina, e outro de distrofia muscular por problema em nervos da medula espinhal. A regra para registro comercial entra em vigor em 60 dias. A partir de então, as empresas que desejarem fazê-lo, podem protocolar os pedidos de registro desse tipo de produto na Anvisa. A partir do pedido a agência terá 120 dias para aprovar o produto em caráter provisório ou 365 dias para aprovação em caráter definitivo.
Fonte: O Globo




This Post Has 0 Comments